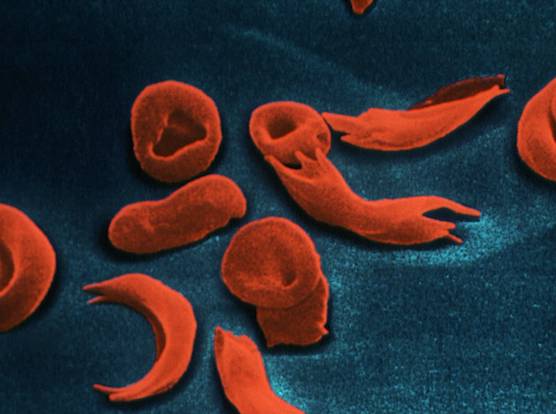
El nombre de anemia falciforme se debe a la anormal forma de hoz (del latín falx) que presentan los hematíes enfermos. Esta enfermedad afecta concretamente a la hemoglobina, la molécula encargada del transporte de oxígeno, y hace que forme grandes agregados fibrosos que se extienden a través de los hematíes deformándolos, de manera que pueden taponar los finos capilares e impedir el flujo sanguíneo. ¿Y por qué el nombre de anemia? Pues porque los hematíes falciformes son menos eficientes en el transporte de oxígeno y, además, no permanecen mucho tiempo en la sangre, lo que encaja con la definición de anemia de baja concentración de hemoglobina.
El origen de la enfermedad fue propuesto, de manera atrevida pero acertada, por Linus Pauling en 1949. Su hipótesis era que estaba causada por una variación específica aminoacídica de una cadena de hemoglobina (la hemoglobina es una proteína formada por cuatro cadenas de aminoácidos). Decíamos que era una hipótesis atrevida porque llegaba cuatro años antes de que Watson y Crick propusieran su modelo del ADN, con lo que atribuirle una enfermedad a una variación en un aminoácido era arriesgado.
La demostración de la teoría de Pauling vino de la mano de Vernon Ingram en 1956. Mediante una cromatografía en dos dimensiones, que consiste básicamente en la separación de proteínas por masa y carga, observó que, en la posición 6 de la cadena β de la hemoglobina mutada, había una valina en vez de un glutamato. A la forma mutada se la llamó hemoglobina S por “sicke” (hoz).
Ahora bien, ¿cómo puede un cambio en un único aminoácido cambiar la estructura y funcionalidad de una proteína entera con más de 500 aminoácidos? El glutamato de la hemoglobina sana es un aminoácido cargado negativamente a pH fisiológico, mientras que la valina de la hemoglobina mutada es hidrofóbica, es decir, sin carga. Pues bien, resulta que la posición donde se encuentra es un lugar estratégico y, cuando la hemoglobina no está unida a oxígeno, la valina forma un enlace hidrofóbico con dos aminoácidos de la cadena vecina: la fenilalanina 85 y la valina 88 (recordad que la hemoglobina está formada por cuatro cadenas de aminoácidos). Este enlace hidrofóbico funciona como una especie de parche adhesivo que hace que la hemoglobina cambie su conformación y precipite formando el agregado.
¿Por qué estos enlaces hidrofóbicos no se forman cuando la hemoglobina sí está unida a oxígeno? La hemoglobina es una proteína alostérica, lo que significa que la unión a ciertas moléculas hace cambiar su conformación. Es el caso del oxígeno, que cuando se une a la hemoglobina hace que sus cadenas se separen y que su estructura se “relaje”, ya que las interacciones internas se hacen más débiles. Así, cuando la hemoglobina mutada está unida a oxígeno, la valina defectuosa está más lejos de sus cadenas vecinas y no se produce el enlace hidrofóbico. Pero cuando ésta se desprende del oxigeno, la estructura se vuelve compacta y sí se produce la unión, con lo que la hemoglobina precipita.
Hoy en día sabemos que la enfermedad está producida por una mutación en un gen del cromosoma 11, concretamente por la sustitución de una adenina por una timina, lo que hace que se sintetize la valina en vez del glutámato que correspondería. La transmisión génica se debe a un gen recesivo; así pues, los individuos homocigóticos (con el gen de la enfermedad transmitido por parte de sus dos progenitores) producirán hematíes defectuosos por todo el tracto venoso y cualquier esfuerzo podría provocarles la muerte. En cambio, los individos heterocigóticos (con el gen de la enfermedad transmitido solo por un progenitos) fabrican la mitad de la hemoglobina defectuosa, con lo que pueden hacer vida prácticamente normal.
Como dato curioso, la población que posee el alelo de la anemia falciforme es resistente a la malaria, una enfermedad transmitida por un parásito, el plasmodium falciparum, que vive en el interior de los hematíes. Este hecho, sin embargo, ha tenido una consecuencia negativa: que en África la anemia falciforme ya afecta a uno de cada cien habitantes. Esto se debe a que la malaria es una enfermedad históricamente endémica de África y, debido a los terribles efectos que produce en la salud, ha hecho aumentar la prevalencia del alelo de la enfermedad (ya que, como hemos dicho, hace inmune a la malaria). Si, además, sumamos la alta natalidad que hay en África, con la transmisión genética que conlleva, entenderemos el terrible porcentaje de enfermos de anemia falciforme.
Para terminar, recordar que el origen de esta enfermedad no es más que la sustitución de una adenina por una timina en el ADN. Parece que estemos indefensos en un mundo donde un simple cambio de un nucleótido pueda producir una enfermedad. Pero creedme que el cuerpo humano es impresionante. Si puede desarrollar una molécula tan compleja como la hemoglobina capaz de transportar el oxígeno por los metros y metros de vasos sanguíneos que poseemos, imaginad de lo que es capaz para defenderse.
————————-
Este artículo participa en los Premios Nikola Tesla de divulgación científica y nos lo envía Juan Vicente Mulet Bayona, estudiante de farmacia en la Universidad de Barcelona.
————————-
Bibliografía:
Bioquímica, editorial Reverte. Jeremy M. Berg, John L. Tymoczko, Lubert Stryer. Sexta edición.
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.
