La posibilidad de adaptar y mantener en crecimiento en placas de laboratorio células vivas obtenidas a partir de tejidos animales o de humanos supuso un enorme avance para el estudio de la biología y la medicina. Pese a las evidentes limitaciones que tiene obtener conocimiento sobre el funcionamiento de un organismo complejo a través del estudio detallado de sus componentes más simples, las células, el desarrollo de la tecnología de cultivo celular ha permitido atisbar los secretos del funcionamiento de la vida, además de habernos aportado una herramienta muy útil para el desarrollo biotecnológico.
Hace ahora medio siglo que uno de los pioneros del cultivo celular, Leonard “Len” Hayflick, realizó un estudio minucioso sobre las características y propiedades de las células humanas en cultivo. Sus precisas anotaciones reflejaban que las células humanas se adaptaban correctamente a las placas de plástico de laboratorio y los medios nutritivos en los que Hayflick cultivaba las células permitían su robusta y continua división.
Sin embargo, invariablemente, los cultivos de células humanas de Hayflick derivaban con el tiempo (con las divisiones celulares en realidad) en unos cultivos de células que cambiaban de aspecto y frenaban su proliferación hasta detenerse por completo.
Las placas que acogían células que llevaban un número elevado de divisiones celulares (y siempre rondaba aproximadamente el mismo número) se llenaban de células más grandes, con depósitos internos y que eran incapaces de volver a dividirse para dar lugar a células hijas. Las células estaban vivas, eran metabólicamente activas, pero eran incapaces de volver a dividirse. Podríamos decir que eran auténticas células zombies.

La difusión de esa observación a través del cauce habitual, la publicación de los resultados en revistas especializadas bajo revisión anónima por otros científicos especializados en el mismo área, le resultó muy difícil a Hayflick. Un eminente científico, el premio Nobel Peyton Rous, actuando como editor de la revista Journal of Experimental Medicine a la que Hayflick había enviado sus conclusiones contestó de manera destemplada prácticamente que lo que ocurría era que Hayflick no tenía ni idea de cómo cultivar células y por eso sus cultivos cesaban de dividirse.
Hay que ponerse en contexto, puesto que el dogma en aquel momento era que, efectivamente, las células en cultivo eran inmortales. A dicha conclusión se había llegado tras los estudios que se habían realizado utilizando células derivadas de tumores humanos durante la primera mitad del siglo pasado. E incluso a partir de datos ampliamente difundidos a principios de siglo por un investigador de enorme prestigio y de polémica personalidad y profesionalidad, el premio Nobel francés Alexis Carrel, quien había asegurado ser capaz de mantener durante más de 20 años cultivos de células procedentes de embriones de pollo establecidos en 1912. Aquellos cultivos en realidad se mantenían gracias a la adición de medios de crecimiento que procedían también de extractos de embriones de pollo y en los que nuevas células frescas encontraban su camino hacia el cultivo establecido, por error … o no.
En cualquier caso, en la mente de todos los científicos que trabajaban con células a mediados del siglo pasado, los organismos eran mortales, pero las piezas básicas que los forman eran esencialmente inmortales, siempre y cuando se les cuidase y aportasen los medios nutritivos correctos. Las observaciones de Hayflick contradecían esta idea y el investigador postulaba que en realidad sus resultados constituían un reflejo del proceso de envejecimiento mostrado por las células en cultivo, y por ello a este fenómeno lo denominó “senescencia celular”.
En realidad hoy sabemos que, como casi siempre, algo de razón había en ambos bandos. Las células que cultivaba Hayflick eran “primarias”, que es como se denomina a las células que se ponen en cultivo directamente desde un tejido sano, sin haber sufrido ninguna modificación en su genoma. Las células inmortales cuyo crecimiento desaforado en cultivo observaban el resto de investigadores procedían de tumores y, por tanto, habían sufrido durante el proceso de conversión en célula tumoral todo tipo de aberraciones genéticas. Entre estas alteraciones que toda célula tumoral que se precie debe portar, se encuentran aquellas que impiden este proceso de senescencia celular, puesto que si algo caracteriza universalmente a las células tumorales es precisamente su capacidad indefinida de proliferación. Que este proceso que impide la división celular ilimitada en cultivo sea un reflejo del envejecimiento a nivel celular es algo que incluso hoy en día no está del todo claro, aunque muchos lo den por sentado.
Que la respuesta de senescencia celular constituye una barrera frente al crecimiento tumoral fue propuesto inicialmente en 1997 por un científico español referente mundial, el investigador del CNIO Manuel Serrano. Lo que Manolo propuso en aquel momento es que las células responden ante situaciones potencialmente peligrosas para su integridad genómica mediante senescencia celular como método seguro de impedir que los errores que pudieran generarse por la situación a la que las células se estén enfrentando se perpetúen y expandan. Impedir la división, entrando en ese estado zombi, asegura que la cosa no vaya a más.

Las visiones críticas con esta propuesta, que surgieron, se apaciguaron cuando varios laboratorios, y entre ellos de nuevo el de Manolo Serrano, demostraron que esta respuesta de senescencia celular se podía verificar dentro de los tumores en modelos experimentales de cáncer usando ratones, así como en muestras humanas de pacientes de cáncer. Lo que en aquel momento quedó claro es que esta respuesta existe y se da en los inicios de procesos tumorales. Gracias (en parte) a ella, estamos protegidos del cáncer y nuestras células se aseguran que en caso de sufrir algún daño genético que active un oncogén, la desatada actividad frenética de ese oncogén activo se verá contrarrestada con la parada impuesta por la maquinaria de senescencia celular.
Algunos investigadores han propuesto que activar esta respuesta dentro de los tumores mediante nuevos fármacos podría ser una estrategia efectiva en el control del cáncer. Estaríamos hablando de zombificar a las células tumorales para impedir su avance, como vía alternativa o complementaria a la de inducir su muerte. Sin embargo, existen dudas sobre la conveniencia de utilizar esta medida, puesto que siempre estaríamos expuestos a la llegada de una potencial señal “resucitadora” que invitase a la célula tumoral a levantarse y andar.

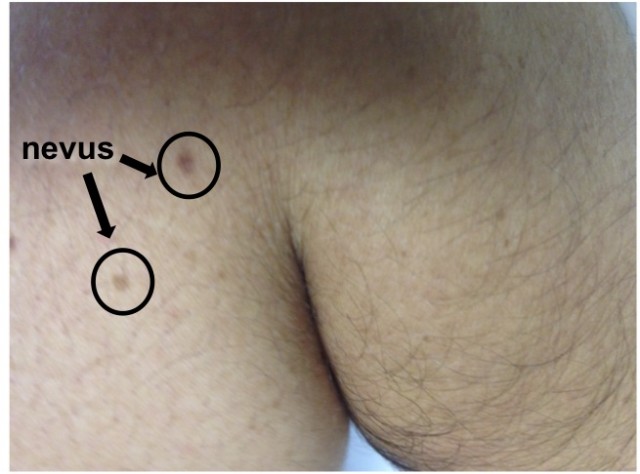
¿Cómo de frecuente es la respuesta de senescencia celular? ¿Podemos verla? En un ejemplo muy gráfico, el investigador holandés Daniel Peeper del NKI de Amsterdam, demostró que los nevus de la piel, esos lunares que todos conocemos y que se van acumulando con el paso de los años, son el resultado de mutaciones potencialmente cancerosas producidas en unas células especializadas de la piel, los melanocitos encargados de producir la melanina que nos protege de los rayos ultravioleta (y nos pone morenos). Estos melanocitos en los que se ha producido una activación oncogénica se dividen inicialmente hasta formar un pequeño grupo de células de color pardo negruzco (que forman el nevus o lunar) hasta que las células imponen la senescencia celular y consiguen frenar el avance de la proliferación que podría culminar en un tumor. De hecho, una lesión similar en la que la senescencia celular no actúa controlando la división es lo que constituye un terrible y mortífero tipo de cáncer, el melanoma.
Quizás ahora, cuando observes al espejo tu piel al desnudo y te encuentres con todos estos nevus, suspires de agradecimiento a la senescencia celular.
Referencias recomendadas:
The serial cultivation of human diploid cell strains.
Hayflick L, Moorhead PS. Exp Cell Res. 1961 Dec;25:585-621.
Cellular senescence in cancer and aging.
Collado M, Blasco MA, Serrano M. Cell. 2007 Jul 27;130(2):223-33.
Senescence in tumours: evidence from mice and humans.
Collado M, Serrano M. Nat Rev Cancer. 2010 Jan;10(1):51-7.
Doctor en Biología Molecular, investigador del Instituto de Investigaciones Sanitarias de Santiago de Compostela (IDIS), dirige el laboratorio de “Células Madre en Cáncer y Envejecimiento”, stemCHUS, en el Complejo Hospitalario Universitario de Santiago (CHUS). Autor del blog de divulgación Fuente de la Eterna Juventud, centrado en la investigación biomédica sobre las causas y las teorías del envejecimiento, y estrategias para su retraso.
