La diabetes está a llamada a ser, sin lugar a duda, la pandemia del siglo XXI. Una enfermedad que cuenta con más de 380 millones de afectados en todo el mundo y de la que se espera contar con 200 millones en los próximos 20 años. Este trastorno metabólico puede clasificarse en dos grandes subclases: diabetes tipo I y tipo II.
La primera consiste en la destrucción de la célula beta del páncreas, encargada de segregar insulina, mediante ataque autoinmune. Esto es, las células del sistema inmunitario de un individuo no reconocen como propias las células beta de su páncreas y las eliminan como si de agentes patógenos se tratasen. La consecuencia principal es la deficiencia de insulina y se corrige con la administración exógena de la misma hormona producida de forma recombinante en laboratorio. El tratamiento intenta imitar la secreción fisiológica de insulina a pesar de que el sistema cumple pobremente su expectativa ideal. ¿Qué hace la insulina? Es un péptido encargado de regular los valores de glucosa en sangre, permitiendo su paso al interior de las células. Por tanto, los individuos diabéticos –del tipo que sean- antes de tratarse padecerán de hiperglucemia: aumento de los niveles circulantes de glucosa en sangre.
La diabetes tipo II en cambio es consecuencia de una resistencia a la insulina debido en gran parte por una dieta alta en grases –lípidos-. Para estos pacientes, en cambio, el tratamiento con insulina se reserva solo para los pronósticos más graves y suele complementarse con agentes o fármacos reguladores de los valores de glucosa en sangre. Además, se precisa de unas recomendaciones tales como hábitos saludables de vida para mejorar el tratamiento. El resultado clínico de estas aproximaciones sigue siendo igualmente pobre y la población diabética acaba expuesta a complicaciones orgánicas de múltiple índole como son neuropatías, retinopatías y problemas cardiovasculares entre otras.
Trasplante de islotes
La primera alternativa estudiada para curar la diabetes fue el trasplante de islotes. Un protocolo puesto a punto en el Congreso de Edmonton, hacia 1998, presentaba el mejor plan diseñado para llevar a cabo la cirugía. A continuación podemos ver en que se basa esta cirugía de forma esquematizada:

La idea no era ni mucho menos mala en el plano teórico pero como muchos de estos trabajos, tiene su talón de Aquiles en la extrapolación a la realidad.
Con las técnicas quirúrgicas actuales no se puede aislar y purificar un número significativo de material obtenido de pacientes vivos por lo que los donantes debían ser cadáveres humanos o porcinos. Además, durante la preparación de nuestras células a partir de los páncreas donantes se perdía mucha cantidad de material por lo que para trasplantar a un paciente receptor con un mínimo de islotes se requerían dos páncreas donantes.
El problema de la fuente de órganos podía ser relativamente fácil de salvar, al fin y al cabo sólo es una cuestión de números, pero la técnica de trasplante resultó mucho más compleja y menos efectiva de lo que se pensaba. Inyectando los islotes directamente en la vena porta sólo podían emplazar unos pocos en el lugar de destino (hígado). Aún así, los pocos que no se perdían durante su paso por la circulación o exhibían dificultades para implantar o bien se volvían a eliminar mediante respuesta inmune. La consecuencia era que el 50% de los pacientes trasplantados volvía a ser insulinodependiente en un plazo menor a un año mientras que el resto lo era antes del cuarto.
A todos estos esfuerzos hay que sumar el tratamiento inmunosupresor que debía administrarse después del trasplante y que normalmente acarreaba alguna que otra complicación derivada.
Hoy en día este trasplante sólo se lleva a la práctica en casos muy excepcionales y no es la norma para cualquier caso de diabetes compleja. Aún así, muchos de los esfuerzos de la investigación actual se basan en técnicas que mejoren el implante de las células trasplantadas así como evitar cualquier tipo de rechazo por el sistema inmune. Un ejemplo es este ensayo con células encapsuladas que les permitiría segregar la insulina sin exponerse a otros elementos celulares que puedan degradarla:
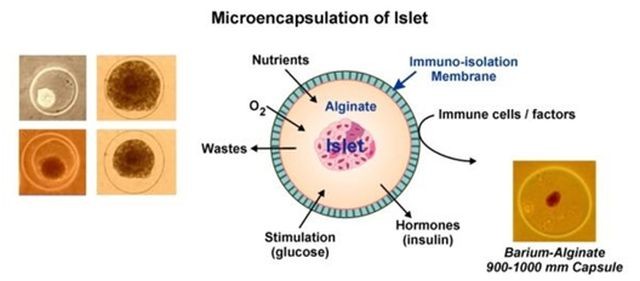
Paralelamente al trasplante de islotes, la posible cura de la diabetes está siendo investigada desde múltiples vertientes. Probablemente la más popular sea la terapia celular.
Terapia celular
1.- Células madre embrionarias:
La promesa de las células madre está empezando a dar resultados para algunas enfermedades degenerativas. En diabetes también los ha dado en algunos modelos animales y nos arroja resultados bastante optimistas en experimentos in vitro. El primer intento deliberado de revertir la falta de células beta con células madre indiferenciadas vino en 2004 de la mano del investigador español (y ex-ministro de Sanidad) Bernat Soria.
Su equipo de científicos en CIBERDEM se propuso inyectar células madre directamente en el páncreas de ratones diabéticos. Se esperaba que las células indiferenciadas pudieran diferenciarse en células pancreáticas promovidas por el entorno donde se trasplantaron y especialmente lo hicieran en células beta para restablecer el equilibro de poblaciones. Aunque los resultados no fueron los esperados, Soria abrió la veda para investigar con células madre en esta enfermedad y a día de hoy se ha recorrido un largo camino.
Para entender porqué falló el experimento de Soria y compañía debemos conocer la estructura anatómica básica del páncreas.

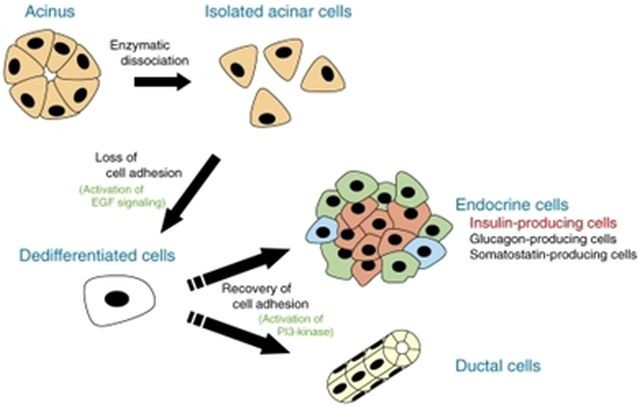
El páncreas es ese órgano amorfo que mostramos en la imagen de arriba. Podemos clasificar sus células en dos grandes tipos: exocrinas y endocrinas. Las células exocrinas son las encargadas de secretar proteínas que intervendrán en la digestión, conforman el 98% del total celular del órgano. Las endocrinas en cambio son el 2% restante y se agrupan en forma de islotes alrededor de los racimos de células acinares (exocrinas) que terminan cada ducto de células ductales (también exocrinas).
Finalmente se vio que las células madre se diferenciaron sobretodo en células exocrinas ya que éstas son la mayor población que ocupa el páncreas.
Mucho ha llovido en los laboratorios de alrededor del globo desde que se diseñó este experimento. Actualmente, se ha conseguido diferenciar células madre en células beta in vitro. El Profesor Melton, en la Universidad de Harvard, ha sido el que ha dado el disparo de salida a la carrera por mejorar su método. A finales de 2014 publicó una particular “receta” molecular en la que podía “cocinar” células beta a partir de células madre y un puñado de factores de transcripción (moléculas que regulan la expresión génica). En tan sólo 30 días podía preparar en un recipiente de medio litro el número de células necesarias para revertir la falta de insulina en un paciente con diabetes.

Desde entonces el método ha sufrido numerosas mejoras y modificaciones adicionales para hacerlo más al uso.
Las células de Melton ya se encuentran en vísperas de fase clínica, ahora es cuando hace falta probar su utilidad en vivo –aunque tenemos indicios en ratones de que las células se comportan como cabría esperar-.

2.- Transdiferenciación:
A falta de nuevas noticias sobre los progresos de las células diferenciadas debemos hacer hincapié en otras estrategias que esperan a la retaguardia los resultados anteriores para posicionarse como una alternativa factible.
Vamos a hablar de la transdiferenciación, el fenómeno que corresponde a la desdiferenciación de un tipo celular cualquiera (pérdida de su identidad) y posterior diferenciación en otro tipo celular. En nuestro caso vamos a hablar de las células que transdiferenciamos a célula beta.
Existen diferentes experimentos con resultados exitosos in vitro, el más relevante quizás sea la transdifrenciación desde células exocrinas:

La reprogramación genética –mediada por vectores virales como los Adenovirus del cuadro superior- ha permitido transformar células que conforman la mayor población del páncreas en células de nuestro interés. Más concretamente, esta diferenciación puede localizarse en el espacio tisular. Reprogramaríamos únicamente las células acinares que se encuentran en el racimo exocrino más próximo a los islotes. Lo mostramos así a continuación:
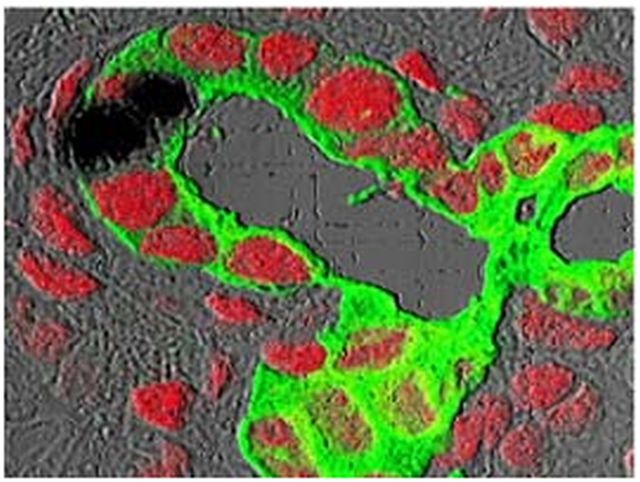
 La principal objeción que se le puede poner a la terapia anterior de cara a enviarla a un ensayo clínico es la seguridad de la reprogramación genético. Hasta el momento sólo se han llevado a cabo réplicas in vitro.
La principal objeción que se le puede poner a la terapia anterior de cara a enviarla a un ensayo clínico es la seguridad de la reprogramación genético. Hasta el momento sólo se han llevado a cabo réplicas in vitro.
2.- Células madre adultas:
La otra estrategia que cabe mencionar es el uso de células madre adultas del propio paciente. Hacia 2009, un grupo de investigación belga confirmó lo que muchas otras pruebas venían indicando tiempo atrás: la existencia de progenitores de células beta en el páncreas.
El equipo, liderador por el Prof. Heimberg, propone dos vías potencialmente terapéuticas para dar uso a estas células. Por una parte, podríamos activar in vitro estas células – aunque primero haría falta aislarlas o bien de pacientes o utilizar un donante universal de la que derivaran todas las consiguientes células -. Hay ciertos puntos que aún andan en el aire. Por ejemplo, ¿cuál sería la vía de administración idónea? Nos evitamos eso sí el rechazo inmune si utilizamos los propios progenitores del paciente pero de todas formas, ¿cómo se mantendría el equilibrio de poblaciones celulares?
Por el contrario, también se podría inducir a la activación in vivo de los progenitores, evitando de forma más clara el rechazo inmune, esquivando el rompecabezas quirúrgico que supondría una nueva vía de administración pero de nuevo sin despejar la incógnita del mantenimiento y regeneración de la población celular.
En el presente nos encontramos debatiendo el punto primigenio, ¿cómo se pueden activar –sea cual sea la vía- este tipo de células madre adultas? Como dice su descubridor, estos progenitores no son más que las bellas durmientes del páncreas adulto, que iniciaron su sueño a edades muy tempranas del desarrollo tisular.
Si algo tienen en común el catálogo de estrategias hasta aquí mostradas es que sobre todas ella pesa la alargada sombra de la autoinmunidad. Y aunque los científicos ya andan manos a la obra con semejante empresa, esta otra historia y deberá ser contada en otro momento…
Este artículo nos lo envía Adrián Villalba estudiante de Bioquímica en la Universidad Autónoma de Barcelona y colaborador en el blog AlbaCiencia.Adrián ha colaborado en diversas ocasiones con Naukas y en este enlace puedes leer sus anteriores artículos.
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.
