¿Quién no ha experimentado lo difícil que resulta abrir una bolsa de plástico cuando está mojada? Las superficies de plástico parecen “pegadas” y se necesita aplicar una cierta fuerza para conseguir que se separen y el aire entre. La “fuerza” que se opone a abrir esas superficies húmedas al aire es la tensión superficial del agua, que tiende a mantener las moléculas del líquido –y las superficies a las que éste está adherido- pegadas entre sí. Traslademos ahora ese problema al trabajo de respirar, es decir a los miles de veces al día que tenemos que llenar nuestros húmedos pulmones de aire. Cada vez que inspiramos, y queremos aumentar el volumen de nuestros pulmones, tenemos que vencer la tensión superficial que se opone a que ampliemos la superficie que nuestros alveolos exponen al aire.
Si dejáramos caer unas gotas de lavavajillas dentro de nuestra bolsa de plástico mojada veríamos cómo la bolsa puede ahora abrirse prácticamente sin ningún esfuerzo. De una forma parecida solucionan nuestros pulmones el problema físico de la respiración. Hay células en los alveolos encargadas de producir una sustancia, el surfactante pulmonar, que actúa de forma análoga al detergente. Forma una película muy fina en la superficie húmeda de los pulmones, de manera que ya no es el agua la que está en contacto con el aire. Eso reduce drásticamente la tensión superficial y la tendencia de nuestros alveolos a “colapsar”, a pegarse y permanecer cerrados. Si nuestros pulmones no dispusieran de ese agente tensioactivo, necesitaríamos gastar alrededor de un 60% de toda la energía que obtenemos del alimento diario solo para el trabajo mecánico de la respiración. Gracias al surfactante, sólo aplicamos un 3% de esa energía al trabajo de respirar.

El sistema surfactante, que reúne lípidos y unas proteínas muy especiales, solo se desarrolla en las últimas etapas del embarazo, cuando los pulmones del bebé se están preparando para empezar a respirar aire tras el parto. En el vientre de la madre, los pulmones están llenos del líquido amniótico, pero eso no es un problema, porque el oxígeno que necesita el feto le llega a través del cordón umbilical. Inmediatamente tras el parto los pulmones deben vaciarse de líquido y llenarse de aire para que el bebé pueda empezar a respirar. Si los pulmones han madurado adecuadamente y contienen surfactante, el vaciado del líquido es fácil y los pulmones se airean adecuadamente desde el primer instante.
Pero ¿qué pasa si un bebé nace prematuramente, antes de la 35ª semana de gestación, antes de que sus pulmones hayan madurado y producido el surfactante destinado a facilitar su apertura? En ese caso, la tensión superficial del líquido impide materialmente sustituir el líquido por aire, y el recién nacido no puede empezar a respirar normalmente. Es lo que se conoce como Síndrome de Dificultad (o Distrés) Respiratoria del Neonato (o SDRN). Hasta finales de los años 80, la única solución era forzar la entrada de aire en esos pulmones mediante ventilación asistida ¡en cada inspiración! Sin embargo, el daño y la inflamación causados en esos pulmones tan frágiles era muy severo, y la mortalidad en esos niños sometidos a un tratamiento tan agresivo era elevada, hasta de un 40%. Un caso muy conocido fue el de Patrick Bouvier Kennedy, el último hijo del Presidente Kennedy, que falleció por esta causa en agosto de 1963, tras nacer prematuramente.

Hoy día Patrick Kennedy habría sobrevivido sin problema, como lo hacen la mayor parte de los recién nacidos prematuros en nuestros hospitales. Eso es posible gracias al desarrollo a finales del siglo pasado del tratamiento de esos niños con surfactantes exógenos, es decir, administrados desde fuera para reemplazar el que los pulmones del bebé aún no han tenido tiempo de producir.
Los ensayos clínicos donde se puso a prueba ese tratamiento pueden incluirse sin duda entre los momentos más emocionantes (y satisfactorios) de la medicina moderna. Cuando se prueba una medicina en pacientes, sin saber si va a funcionar, los ensayos clínicos se realizan habitualmente administrando la medicina o tratamiento que se quiere ensayar solo a la mitad de los pacientes, mientras a la otra mitad se le administra un placebo, algo que se parece a la medicina pero no lo es. Sólo así puede determinarse si la medicina en cuestión realmente mejora la situación del paciente. Además, estos ensayos se realizan en condiciones doble-ciegas, es decir, que ni el paciente (o su familia) ni el médico saben si a un paciente determinado se le está administrando la medicina o el placebo. Ello, claro, para evitar que sean la actitud o las ganas de pacientes y médicos de que la medicina funcione lo que realmente mejore al paciente y no la medicina en sí misma.
A pesar de eso, cuando se probó el tratamiento de los bebés prematuros con surfactantes exógenos, los médicos sabían inmediatamente a qué bebés se estaba administrando un surfactante de verdad y a cuales un simulacro, porque los que recibían el preparado adecuado empezaban a inflar sus pulmones sin esfuerzo, a respirar y a tomar el color rosado que caracteriza un bebé sano y bien oxigenado. Mientras, los niños que recibían el placebo, continuaban teniendo problemas respiratorios severos y falta de oxigenación. Como puede imaginarse, el ensayo clínico se suspendió inmediatamente para proporcionar a todos los bebés el surfactante exógeno que les salvaba la vida.
Aún hoy, constituye este el caso más espectacular de un medicamento llevado a su uso clínico de la forma más inmediata. Es igualmente espectacular comprobar la drástica caída de mortalidad en las estadísticas de nacimientos a partir de los 80 y 90, gracias a la implantación de la terapia con surfactante exógeno y a la mejora de las técnicas de cuidados intensivos aplicadas a los recién nacidos. Pueden obtenerse más detalles sobre el descubrimiento del surfactante y de la terapia con surfactante exógeno aquí.
En la actualidad, en la mayoría de los servicios de neonatología de los hospitales en países desarrollados se aplica el tratamiento con surfactante exógeno a los niños que lo necesitan. A los recién nacidos muy prematuros se les entuba, y mediante el tubo endotraqueal se les administra un “bolo” de surfactante concentrado. En la mayoría de los casos, solo es necesaria la administración de una única dosis de este surfactante clínico, pues el propio funcionamiento del pulmón estimula la maduración y producción del surfactante propio. Es decir, que el surfactante exógeno actúa prácticamente como un mero iniciador de la mecánica respiratoria, que, eso sí, debe aplicarse lo antes posible tras el nacimiento, para que el pulmón nunca empiece a funcionar en ausencia de la película protectora.

Hay que destacar que los surfactantes que se administran hoy día a los recién nacidos son preparados extraídos de pulmones animales, habitualmente porcinos o bovinos. La razón por la que hay que acudir a materiales de origen animal también explica que esta técnica no se desarrollara hasta casi el final del siglo XX. Mary Avery, una extraordinaria científica y pediatra, ya había identificado en Harvard en 1959 que era la falta de un material tensioactivo en sus pulmones lo que impedía a los niños prematuros respirar con normalidad. Sin embargo, todo intento de ayudar a esos niños administrándoles la mezcla de lípidos que aparentemente constituía el surfactante resultó infructuoso.
Fueron los experimentos pioneros de Tetsuro Fujiwara en Japón en los 70 y 80 los que demostraron que la administración de extractos que se suponía que eran solo “lipídicos”, obtenidos de pulmones animales, podía salvar a esos recién nacidos prematuros.

No tardó en descubrirse que en los extractos de origen animal, además de los lípidos, se encuentran cantidades mínimas, pero indispensables, de dos pequeñas proteínas que ahora conocemos como SP-B (acrónimo de “Surfactant Protein B”) y SP-C, extraordinariamente hidrofóbicas (se comportan como si fueran lípidos) y muy difíciles de detectar.
Ningún niño –ni adulto- puede respirar en ausencia de estas proteínas SP-B y SP-C, y todos los surfactantes que se administran hoy día en los servicios de neonatología contienen proporciones mayores o menores de ellas. Posteriormente también se ha descubierto que diferentes casos de niños fallecidos como consecuencia de fallo respiratorio irreversible tras el nacimiento se debían a problemas congénitos que daban lugar a la falta de estas proteínas.
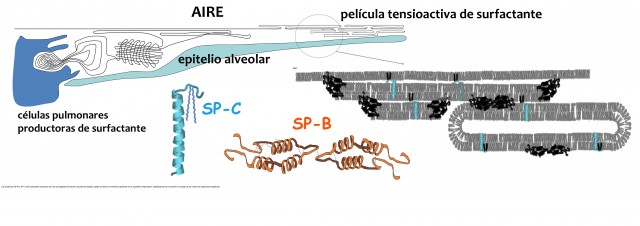
El objetivo fundamental de la investigación que desarrollan diferentes equipos en el mundo, por ejemplo nuestro grupo BIOMIL de la Universidad Complutense, se dirige a entender los mecanismos moleculares que hacen que estas proteínas sean esenciales. Lo que sabemos por ahora, tras varias décadas de investigación, es que estas proteínas son las encargadas de llevar los lípidos tensioactivos, los que en último término van a producir la dramática reducción de tensión superficial, desde las células del pulmón hasta la superficie respiratoria, para formar una película protectora que resista los miles y miles de ciclos de inspiración-espiración a que sometemos a nuestros pulmones. Supone en este sentido un reto reproducir en el laboratorio las condiciones en las que tiene que funcionar un surfactante pulmonar eficiente, y en la Universidad Complutense hemos diseñado equipos especiales capaces de simular un alveolo durante la mecánica respiratoria, pero eso merece otra futura entrada.
La comprensión de los mecanismos de funcionamientos de estas proteínas está permitiendo, por otra parte, el diseño y producción de materiales surfactantes alternativos destinados a sustituir a los productos de origen animal. La obtención de surfactantes a partir de animales es extraordinariamente cara y limitada, y aunque el tratamiento de los prematuros que lo necesiten está garantizado, la falta de surfactantes humanizados en cantidad suficiente está impidiendo el desarrollo de tratamientos innovadores para otras enfermedades respiratorias de niños y adultos, en las que la administración de un material que facilite la mecánica respiratoria podría también ser una solución.
El futuro pasa por la obtención de las proteínas SP-B y SP-C del surfactante pulmonar humano mediante ingeniería genética y biotecnología, para su posterior utilización en la fabricación de surfactantes humanos análogos a los que fabrican de forma natural nuestros pulmones.
Por ejemplo, ya hemos sido capaces de insertar el gen que produce la SP-C humana en bacterias, para convertirlas en biofactorías que se pueden cultivar indefinidamente mientras fabrican gramos de esta proteína lista para su extracción. Es un ejemplo espectacular de cómo la generación de organismos modificados genéticamente (OMGs) puede abrir perspectivas sin precedente en el desarrollo de nuevos tratamientos biomédicos.
Sin embargo, nadie en el mundo ha sido aún capaz de producir la proteína más importante del surfactante, la única de la que no podemos prescindir ni siquiera temporalmente, la SP-B. La razón estriba en su alta hidrofobicidad (no es soluble en agua, lo que hace que fácilmente agregue o precipite, o se pegue a cualquier superficie) y en la complejidad de su estructura. Para dar una idea de ello, valga tener en cuenta que en las células del pulmón, esta proteína, compuesta por 79 aminoácidos, se sintetiza como un precursor –proSP-B- de más de 400, que luego es cortado progresivamente según se ensambla para formar los complejos lipoproteicos del surfactante. Reproducir todo ese complejo procesamiento en cultivos de células de forma que proporcionen cantidades ilimitadas de producto está siendo de momento un desafío insuperable.
Una alternativa prometedora es el desarrollo de reactores productores de surfactante pulmonar humano a partir del cultivo de células madre reconvertidas en células pulmonares. Por ejemplo, hemos conseguido cultivar células madre derivadas de placenta humana, un material de desecho, para multiplicarlas y diferenciarlas a células productoras de surfactante pulmonar. El surfactante que producen está disponible aún en cantidades muy reducidas, y es difícil aventurar hasta donde podrá elevarse su escala de producción. Sin embargo, es una prueba de concepto que demuestra cómo la aplicación combinada de tecnologías de modificación genética de organismos y de desarrollo de biofactorías biotecnológicas puede abrir un futuro esperanzador para el tratamiento de enfermedades y problemas biomédicos aún sin solución.
Este artículo nos lo envía Jesús Pérez Gil (@Birloque) es Catedrático de Bioquímica y Biología Molecular, en la Universidad Complutense y Director del Grupo de Investigación BIOMIL. Recientemente ha sido elegido Presidente de la Sociedad Española de Biofísica.
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.
