Seguro que has oído alguna vez que se ha usado la «prueba del carbono-14» (C-14) para determinar la antigüedad de alguna muestra biológica, como restos humanos, una pieza de madera o incluso fibras de tejido (como la «sábana santa» de Turín).
El método funciona perfectamente para restos de hace 20 mil años, pero no para los de hace sólo 50 o 60 años. ¿Te imaginas por qué?
Explicación corta
Tan corta, que con una sola imagen de la estupidez humana basta:

Explicación larga
Como seguro sabrás, un mismo elemento químico viene en la Naturaleza en distintos «sabores», con la particularidad de que todos ellos parecen idénticos, reaccionan con las mismas sustancias, etc. Solamente se diferencian entre sí, muy ligeramente, en sus masas atómicas. Son los isótopos de un elemento.
El aire que expulsas al respirar está lleno de dióxido de carbono (CO2), proveniente de la «quema» (reacción con oxígeno, O2) de moléculas ricas en carbono (C) que el cuerpo utiliza para sacar la energía que nos mantiene vivos. Ese carbono, en forma de glucosa o de hidratos de carbono, viene a su vez de lo que comemos que, en última instancia, se origina en las plantas que lo capturan del aire al realizar la fotosíntesis.
Por lo tanto, con cada respiración estás cerrando un largo ciclo, devolviendo a la atmósfera el carbono fijado por plantas dios sabe dónde hace semanas o meses. Lo mismo, pero a escalas industriales y remontándonos al carbono fijado hace millones de años es lo que ocurre al quemar carbón o petróleo.

Lo curioso de este ciclo es que no importa qué isótopos del elemento carbono formen parte de él: ni las plantas ni tu cuerpo discrimina entre ellos, ya que todos le parecen iguales. ¡Recuerda que los isótopos son todos químicamente idénticos!
Por tanto, cabe esperar que el carbono fijado por las plantas contenga, de media (pero de forma muy precisa), la misma proporción de isótopos que el aire de la atmósfera. De los tres isótopos que se encuentran en la naturaleza, el C-12 y el C-13 son estables y representan el 99% del carbono en la Tierra. El 1% restante es radiactivo y, como adivinarás, es el famoso C-14.
Durante la vida de las plantas y animales, estamos continuamente intercambiando carbono con el entorno, por lo que lo normal es que mantengamos un porcentaje de C-14 aproximadamente constante en relación al resto de isótopos, e igual al porcentaje de equilibrio que existe en la Tierra.
Pero al morir, el intercambio cesa y solamente queda la desintegración radiactiva de tipo decaimiento beta por la que el C-14 se convierte, por arte de magia, en nitrógeno.
El proceso de desintegración es aleatorio, pero sigue un patrón perfectamente conocido. Así que si medimos el porcentaje de C-14 que queda en una muestra y conocemos la concentración inicial (la de la última atmósfera que respiró el ser vivo antes de morir) es cuestión de matemáticas despejar el tiempo de la ecuación y voilà, ¡hemos averiguado los años que lleva muerta nuestra muestra!
La pega está, claro, en saber cómo era la atmósfera de tiempos pasados. Los científicos creen que, exceptuando variaciones menores debidos a cambios en el sol y en el clima, el porcentaje de C-14 se ha mantenido bastante estable durante decenas de miles de años… hasta la década de 1950, época en que comenzó la estúpida carrera por ver qué país explotaba la bomba nuclear más gorda en nuestra propia atmósfera.

Con cada detonación se liberaron al aire numerosos isótopos radiactivos, muchos de corta vida, y otros como el C-14, de no tan corta (~5700 años de vida media). Durante unos años, la concentración en el hemisferio norte casi llegó a duplicarse.
Lo peor, a efectos de datación mediante C-14 es la gran incertidumbre sobre cuáles fueron los niveles medios del isótopo en cada lugar del planeta durante la segunda mitad del siglo XX, ya que un valor casi constante durante milenios de pronto estaba pegando brincos por semanas. Y sin un valor inicial fiable, la concentración medida en una muestra bajo estudio no nos dice absolutamente nada.
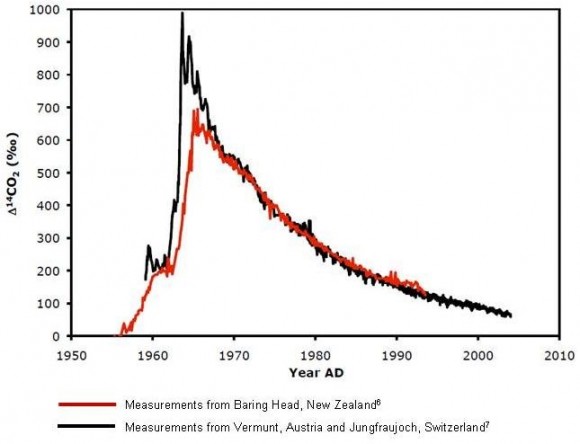
¿Cuándo dirías que se firmó el primer tratado internacional de prohibición de ensayos nucleares? Fue en 1963, así que imagina hasta dónde podría haber llegado la concentración de isótopos de haber continuado la loca carrera nuclear.
Extras (solo para quisquillosos)
Extra 1: Para los que quieran saber un poco más sobre los métodos para medir cuánto C-14 hay en una muestra, podéis ver esta página donde resume el método «barato» de extracción del carbono por medios químicos. Existe una alternativa, mucho más cara pero más precisa y que permite trabajar con muestras de miligramos, basada en espectroscopia de masas con la luz de un acelerador de partículas.
Extra 2: Quizás te hayas percatado de un punto importante que me he saltado arriba: ¿si el C-14 es inestable, cómo puede existir un equilibrio en la atmósfera? ¿No debería existir alguna fuente de C-14?
Efectivamente, esa fuente natural de C-14 existe y se debe a las reacciones (nucleares) que tienen lugar en las capas altas de la atmósfera. Los rayos cósmicos generan reacciones en cadena al chocar con los núcleos de las moléculas del aire, y algunos de los neutrones que salen despedidos a toda velocidad chocan con núcleos de nitrógeno y se transforman (¡magia de la física!) en carbono, del tipo C-14.

Extra 3: Realmente, no es imposible datar una muestra posterior al año 1950 por medio del C-14. Pero además del problema de obtener valores de referencia precisos existe una complicación añadida: para un extenso rango de valores de concentraciones existen dos o más «picos de probabilidad» (distribución de probabilidad multimodal) sobre potenciales dataciones.
Como se ve en la gráfica, para un valor medido (una línea horizontal) se cortaría a la gráfica de concentraciones en más de un punto, como el ejemplo que no podríamos saber si data de ~1963 o de ~1985:

Extra 4: Otra complicación más para dataciones recientes proviene de la quema de combustibles fósiles, que están liberando a la atmósfera isótopos C-14 que llevaban encerrados bajo tierra millones de años.
————————
Este artículo participa en los Premios Nikola Tesla de divulgación científica y nos lo envía Jose Luis Blanco. Como él mismo nos explica en su mail: «Soy Doctor de los que no curan e Ingeniero en Telecomunicaciones, y actualmente trabajo como profesor en la Universidad de Málaga. Con una probabilidad del 99,7% controlo temas de estimación estadística y sus aplicaciones a robótica y visión por ordenador, aunque me encanta divulgar sobre cualquier rama de la física o las matemáticas«. Puedes visitar su blog Ciencia explicada y seguirlo en twitter en @BlogCienciaExpl.
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.
