
Pocos procesos existen en la naturaleza con tantas implicaciones y aplicaciones como el de la ósmosis. Baste decir que, como se verá más adelante, es responsable de aspectos tan variados como el intercambio de agua que se produce en las paredes de las células de los seres vivos, el aumento de tamaño de las legumbres “en remojo”, el encogimiento de los pepinillos en un baño de vinagre con sal o el hecho de que, con una técnica adecuada, se pueda desalar el agua de mar para obtener agua potable.
Curiosamente es de los pocos fenómenos fisicoquímicos con nombre “extraño” para los profanos, que se emplea en el lenguaje cotidiano. Por ejemplo, se indica que alguien “aprende por ósmosis” cuando, sin grandes conocimientos previos adquiere, poco a poco, cierta idea sobre un tema concreto. Así, en el contexto de la crisis económica actual, todos hemos aprendido, por “ósmosis”, lo que es la prima de riesgo o la rentabilidad de un bono.
El término ósmosis procede de la palabra griega ώσμός (osmós), que significa “acción de empujar”. Este apunte etimológico quizá sea de ayuda para la comprensión del fenómeno y de algunas de sus innumerables aplicaciones.
Antes de definir la ósmosis, es necesario introducir cierto vocabulario químico. Así, la cantidad de sustancia disuelta (denominada soluto) en un medio líquido (conocido como disolvente) como el agua, se denomina concentración, y la mezcla homogénea formada por el disolvente y el soluto se conoce como disolución. Si disolvemos sal común en agua habremos preparado una disolución con ese soluto (que en química denominaríamos cloruro de sodio) y ese disolvente (el “líquido elemento” de los clásicos), tan habituales ambos en nuestro mundo.
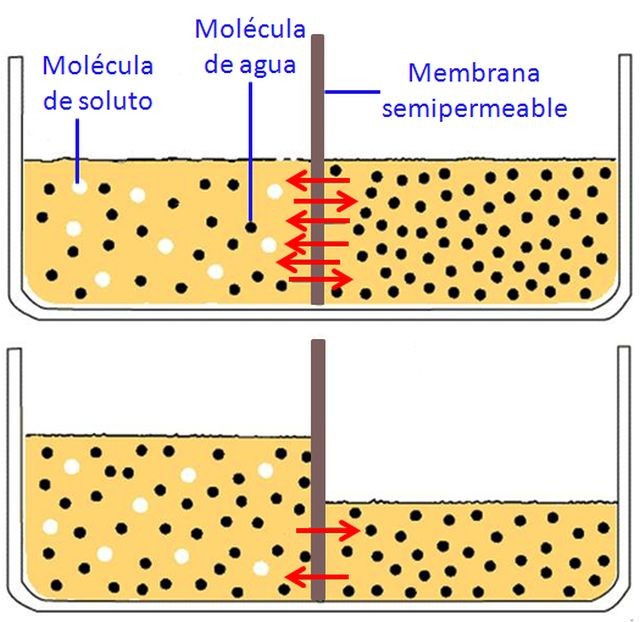
Ahora ya sí podemos indicar que la ósmosis es el fenómeno por el que el agua pasa a través de una membrana semipermeable que separa dos disoluciones acuosas de distinta concentración. Pero en todo caso, vemos algo común en ciencia: al definir un concepto, debemos definir o especificar otros. ¡Y para eso estamos los científicos!
Una membrana semipermeable es aquélla que permite el paso sólo de ciertas especies químicas a través de ella, como son las moléculas de agua (disolvente) pero no de los otros componentes de una disolución. La distinta permeabilidad presentada para unas sustancias y otras se produce, esencialmente, por la existencia de poros de diferente tamaño y geometría en la membrana.
Aunque el fenómeno de ósmosis se da también para disoluciones líquidas no acuosas, es con el agua donde se produce más frecuentemente, tanto en la naturaleza como en la práctica industrial. Por eso nos referiremos siempre en este texto a medios acuosos, si bien es fácil extrapolar lo explicado a otros medios líquidos.
Hasta ahora se ha indicado que la ósmosis consiste en un flujo de agua, pero falta concretar un detalle fundamental: ¿en qué sentido se desplaza el agua, hacia donde hay más proporción de soluto (disolución más concentrada) o en sentido contrario (hacia la disolución más diluida)? La respuesta no da lugar a dudas; aunque las moléculas de agua (cuya fórmula es la bien conocida “hache dos o”) se pueden desplazar en ambas direcciones, porque son capaces de atravesar los poros de la membrana, hay un flujo mayor de dichas moléculas hacia donde la proporción de agua es menor. A nivel macroscópico, se produce así un flujo neto de agua desde la disolución más diluida a la más concentrada. En otras palabras, se produce una tendencia natural para igualar las concentraciones de las disoluciones separadas por la membrana semipermeable y, al no poder ser atravesada ésta por las partículas de soluto (que irían hacia donde su concentración es menor), lo hacen las de disolvente, pero en sentido contrario.
La tendencia de una disolución acuosa para producir ósmosis se mide por la presión osmótica. Es la presión que habría que aplicar sobre ella para evitar el “flujo osmótico” que provocaría agua pura que estuviera en contacto a través de una membrana semipermeable. La presión osmótica aumenta al hacerlo la temperatura y la concentración de especies disueltas, siendo prácticamente independiente del tipo de soluto. Las propiedades fisicoquímicas, como la ósmosis, que dependen de la concentración pero no del soluto se denominan “propiedades coligativas” de las disoluciones.
Uno de los descubridores de la ósmosis fue el fisiólogo francés René Joachim Henri Dutrochet, nacido en 1776 en el castillo de Néons-sur-Creuse (población del departamento francés de Indre) en el seno de una familia noble que se vería arruinada por la Revolución. Ejerció como médico militar en Burgos [1], hasta que contrajo el tifus y volvió a su país, donde se dedicó por entero a la investigación. Descubrió el fenómeno de la ósmosis observando el comportamiento de ciertas cápsulas que obtenía en llagas de colas de pescado. Destacó también por sus estudios sobre el desarrollo embrionario y sobre el efecto de la luz en las plantas (comprobando que se desprende oxígeno en el proceso que hoy conocemos como fotosíntesis). Es considerado, además, uno de los padres de la teoría celular, al sostener que todos los seres vivos están formados por asociaciones de células. En conjunto, sus trabajos se distinguieron por una gran originalidad, al esforzarse en explicar los fenómenos propios de la vida según leyes fisicoquímicas, algo poco frecuente en aquella época.
Hoy se sabe que la realidad última que provoca el fenómeno de ósmosis es la diferencia de potencial químico [2] entre dos disoluciones que se encuentran a ambos lados de una membrana semipermeable. El proceso de ósmosis se interrumpe cuando se alcanza el equilibrio entre los potenciales químicos de las dos disoluciones. Dicho equilibrio, como otros equilibrios químicos (y físicos), es dinámico: no se termina el flujo de disolvente a través de la membrana semipermeable, sino que se igualan las velocidades a las que el agua pasa de un lado a otro en ambas direcciones.
Las legumbres como los garbanzos, las judías o las lentejas, se suelen dejar “en remojo” con agua, la noche antes de cocinarlas, para preparar un exquisito cocido madrileño o una suculenta fabada asturiana, por poner dos ejemplos cercanos. Con ello se hinchan y se facilita, como todos sabemos por experiencia, su ablandamiento. Es un efecto que, a los ojos de los niños, por ejemplo, se presenta como algo mágico o, al menos, curioso. El fenómeno se produce por ósmosis: la concentración de distintos solutos en el medio acuoso, dentro de la legumbre, es mayor que en el agua de inmersión y la piel actúa como una membrana semipermeable. Buscando el equilibrio entre la composición del interior y la del exterior, se produce la entrada neta de agua hasta que la presión osmótica de la legumbre provoca la interrupción de ese flujo.
¿Podría hacerse un proceso análogo a la hidratación de las legumbres en remojo pero en sentido contrario? Sí, es lo que ocurre con los alimentos conservados en disoluciones concentradas, como los pepinillos sumergidos en vinagre con sal, que se contraen por pérdida de agua, dado que ésta fluye, desde dentro del pepinillo, hacia la disolución más concentrada.

Cada vez son más consumidas (por ejemplo por deportistas) las bebidas “isotónicas”, que también guardan relación con el fenómeno de la ósmosis. Dos disoluciones son isotónicas si tienen la misma presión osmótica. Por ejemplo, el suero intravenoso es una disolución salina isotónica porque tiene la misma presión osmótica que la sangre. Por eso, no produce alteraciones en las células al introducirse en el organismo. Si el suero fuera hipertónico (con mayor presión osmótica que el organismo) provocaría la deshidratación de las células, al ceder éstas agua a la sangre. Si el suero fuera hipotónico (menor presión osmótica), las células se hincharían por absorción de agua, lo que también resultaría peligroso. Por esta razón, los eritrocitos o glóbulos rojos de la sangre se arrugan (fenómeno de crenación) en contacto con una disolución hipertónica y se llegan a romper (hemólisis) al hincharse por penetración del agua en contacto con disolución hipotónica.
Algo parecido al primer aspecto descrito para los glóbulos rojos es el fenómeno que explica, al menos en parte, la conservación de alimentos (como carne y pescado) en salazón o con azúcar (esencialmente para algunas frutas). Al disponerlo en un medio fuertemente hipertónico, que absorbe el agua, se deseca el alimento, con lo que parte de las bacterias y otros microorganismos que lo degradan se encogen y mueren, o al menos se impide su desarrollo, dado que necesitan humedad para vivir.
Las raíces de las plantas absorben agua, por ósmosis, de los fluidos hipotónicos presentes en suelo que las rodea. El agua asciende por la planta, venciendo la fuerza de atracción gravitatoria, gracias a la presión osmótica (aunque también, en parte, por el fenómeno de capilaridad). La propia estabilidad mecánica de las plantas se explica por el fenómeno osmótico, por la existencia de una membrana semipermeable dentro de la pared celular de celulosa. Cuando la planta tiene suficiente agua, la membrana se expande, empujando a la pared celular, lo que da al tallo la rigidez adecuada. Si hay sequía, la membrana no está completamente llena de agua y se separa de la pared celular, con lo que las plantas se marchitan.
El agua de mar contiene una concentración elevada de sales, por lo que es hipertónica frente a nuestro organismo. Si se bebe, las células del cuerpo ceden agua, produciéndose una deshidratación que podría llegar a ser mortal, como lamentablemente han padecido muchos náufragos. Paradójicamente, se puede morir de sed en medio del océano. Eso lo vemos a menudo en televisión y en noticias de prensa, cuando se relata el terrible destino que sufren muchos africanos que buscan una vida mejor aventurándose en cayucos y pateras, con escasez de agua potable, para atravesar el mar.
Con lo razonado anteriormente, cabe preguntarse cómo pueden vivir los animales acuáticos en su medio. Los peces también necesitan agua para vivir; si no la tomasen, morirían deshidratados. En el caso de los peces de mar, pierden agua de forma continua, a través de sus branquias, por ósmosis, al ser la concentración salina del mar mayor que la de su organismo. Deben beber agua de mar continuamente para combatir la deshidratación, y eliminan el exceso de sal que acumulan en su organismo a través de la orina y del epitelio branquial.
Por el contrario, los peces de agua dulce no necesitan beber agua, dado que ésta se absorbe a través de su piel, reteniendo sus riñones las sales esenciales. En resumen, una de las claves de que los peces no puedan sobrevivir de igual manera en agua salada que en agua dulce, se debe al mecanismo contrario de control de líquidos y sales por los riñones: los de agua salada deben producir pequeñas cantidades de orina muy concentrada, mientras que los de agua dulce deben eliminar grandes cantidades de orina muy diluida. Si la salinidad del agua (de mar o de río) cambiase de forma brusca, los peces que habitan en ese entorno no sobrevivirían demasiado tiempo. Hay especies, como el salmón, que nacen en agua dulce, pero viven en el mar, volviendo a los ríos para desovar, en un viaje titánico, que supone superar veloces cursos fluviales, remontar cascadas y, en algunos casos, sortear las garras de hambrientos osos (como se muestra frecuentemente en documentales televisivos). Cuando habitan en el mar, los salmones beben agua salada, eliminando el exceso de sales, pero cuando habitan en agua dulce, dejan de beber agua, absorbiéndola por ósmosis a través de la piel.
Una aplicación de la ósmosis para desalar el agua de mar y obtener agua dulce (que puede llegar a ser potable), consiste en poner en contacto el agua marina (rica en sales) con agua pura, a través de una membrana semipermeable, y ejercer sobre el agua salada una presión mayor que la osmótica. Se trata de la técnica conocida como ósmosis inversa, en la que el agua fluye de la disolución concentrada en sales (agua de mar) hacia la zona de agua pura. Hay desaladoras manuales en pequeña escala, que funcionan por ósmosis inversa, para uso en campamentos y en viajes marítimos con pequeñas embarcaciones. Es también el método empleado en la mayor parte de las plantas desaladoras que existen en nuestro país.
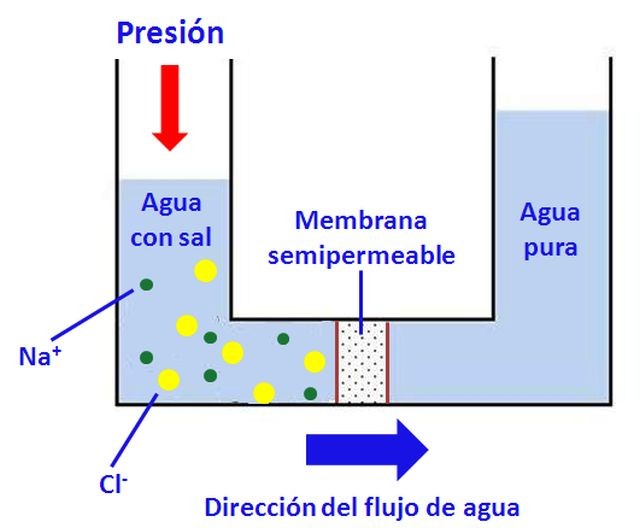
Las membranas empleadas para ósmosis inversa deben tener una serie de características especiales, como son la resistencia química frente al agua salina y la suficiente resistencia mecánica como para no romperse al aplicarse las elevadas presiones necesarias. Esto se consigue gracias al conocimiento que aporta la ciencia y tecnología de los materiales. En la práctica, para la desalación del agua de mar, no se procede con una membrana única, sino con un conjunto de membranas dispuestas en finos y largos tubos interconectados entre sí. Por otra parte, conseguir la presión necesaria implica un elevado consumo energético que encarece el proceso. Al separar agua pura queda, como residuo, una salmuera (agua con alta concentración salina), que plantea ciertos problemas de vertido; de hecho, para no alterar la concentración salina cerca de la costa, debe verterse mar adentro.
Como puede apreciarse, la ósmosis inversa para potabilizar el agua de mar, dadas sus implicaciones, es un ejemplo interesante de lo que se conoce, en el ámbito filosófico y pedagógico como enfoque de Ciencia, Tecnología, Sociedad y Medio Ambiente. Y es un aspecto que está abierto a distintas soluciones, porque el reto de conseguir mejores rendimientos energéticos o materiales más óptimos para la fabricación de membranas adecuadas sigue en marcha.
En resumen, y como conclusión final, se destaca que las propiedades fisicoquímicas, como la ósmosis, no sólo explican multitud de fenómenos naturales de interés, sino que su comprensión, fruto del esfuerzo de científicos y tecnólogos de distintas épocas y países, permite aplicarlos para solucionar problemas concretos y, además, siempre con posibilidades de mejora.
Este artículo nos lo envía Gabriel Pinto Cañón. Doctor en CC. Químicas por la Universidad Complutense de Madrid, es Catedrático de Ingeniería Química en la Universidad Politécnica de Madrid. Aparte de su investigación sobre preparación y caracterización de materiales compuestos de matriz polimérica, ha dedicado un esfuerzo desde hace tres décadas a la didáctica y divulgación de la química, la física y la tecnología
NOTAS:
[1] No fue el único científico francés que pasó por España por aquella época aunque, en su caso, su estancia estuvo relacionada con la ocupación francesa y su condición de militar. Pocos años antes, trabajaron en nuestro país, enseñando química y metalurgia, Joseph Louis Proust (que enunció su conocida ley de proporciones definidas mientras trabajaba en el Real Colegio de Artillería de Segovia) y Pierre François Chavaneau.
[2] El potencial químico, cuyo símbolo es la letra griega mu, µ, es un concepto termodinámico de cierta complejidad, introducido por el científico norteamericano Josiah Willard Gibbs sobre 1876 y cuyo tratamiento excede el nivel de este texto. Se define como el cambio de energía libre cuando el número de partículas de una especie se incrementa en una unidad.
BIBLIOGRAFÍA:
- Y. Cath, A. E. Childress, M. Elimelech, “Forward osmosis: principles, applications, and recent developments”, Journal of Membrane Science, 281, 70-87 (2006).
- Fritzmann, J. Löwenberg, T. Wintgens, T. Melin, “State-of-the-art of reverse osmosis desalination», Desalination, 216, 1-76 (2007).
- G. Pinto, A. Esín, “Kinetics of the osmotic hydration of chickpeas”, Journal of Chemical Education, 81, 532-536 (2004).
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.
