
Cuando pensamos en un delicioso perrito caliente o en un exótico sushi, con total seguridad nos vienen a la cabeza (aparte de las salchichas y el pescado crudo!), condimentos tan sabrosos como la mostaza y el wasabi, con su clásica pungencia que sube rápidamente a las fosas nasales y te deja sin respiración para luego extinguirse sin dejar prácticamente ni rastro, a diferencia del picante sabor de las guindillas o los jalapeños que es bastante persistente y cuyo responsable son los capsaicinoides que ya comenté en un artículo anterior. En la mostaza, el wasabi, los rábanos rojos, etc…la pungencia se debe a unos compuestos llamados glucosinolatos que son característicos de la familia de las Brasicáceas, especies como la col, los rábanos, la colza, el bimi, la rúcula o la planta modelo en investigación, Arabidopsis thaliana, pertenecen a esta familia (Figura 1).
En los vegetales, existen unos compuestos llamados fitoanticipinas que son sintetizados en forma inactiva pero que, en respuesta al ataque por plagas y patógenos, son modificados químicamente para incrementar su toxicidad. Por otro lado, existen también otros compuestos implicados en defensa y que se sintetizan ya en su forma activa en respuesta al ataque patogénico, que se llaman fitoalexinas. En distintas especies vegetales, el papel de fitoanticipinas y fitoalexinas lo pueden desarrollar distintos metabolitos característicos. En la familia de las Cruciferas, y en el caso particular de las Brasicáceas ese papel lo desarrollan principalmente los glucosinolatos, tras su conversión a derivados activos mediante la acción del enzima mirosinasa, así como otros compuestos relacionados, como la camalexina1, respectivamente. No obstante y tal y como se ha mencionado antes, las fitoalexinas más abundantes pueden ser diferentes, incluso dentro de la misma familia; por ejemplo, en la crucífera Thellungiella salsuginea, pariente de A. thaliana, la camalexina no se encuentra y si se detecta otra fitoalexina similar llamada wasalexina2.

Los glucosinolatos poseen estructuras muy variables pero todos ellos comparten un enlace de azufre a un azúcar (tioglucósido) y un enlace nitrógeno a sulfato (aldoxima sulfatada), ambos unidos a un carbono central (Figura 2). La parte variable o cadena lateral (R) va a depender de su precursor y determinará el tipo de glucosinolato así como su actividad. Así pues, se pueden dividir en glucosinolatos alifáticos, unidos a una cadena carbonatada lineal; aromáticos, son glucosinolatos alifáticos pero la cadena lateral carbonatada es de carácter aromático, es decir, contiene grupos benzilo o fenilo, éstos pueden contener azufre en la cadena lateral o no, y, finalmente, los glucosinolatos indólicos, cuya cadena lateral contiene un indol, pudiendo estar éste metoxilado en distintas posiciones o hidroxilado (Figura 3). Todos los glucosinolatos se sintetizan a partir de aminoácidos: los alifáticos se sintetizan a partir de metionina pero también alanina, leucina o valina, los aromáticos a partir de fenilalanina o tirosina, y los indólicos parten de triptófano (Figura 3), que también es el precursor de la camalexina y las auxinas, hormonas vegetales implicadas en el crecimiento y desarrollo.

Tal y como comentaba en un artículo anterior, las plantas sintetizan distintos compuestos con el objetivo de aclimatarse y responder mejor al ambiente y no para complacernos con sus colores, aromas o sabores. En este sentido, se han observado variaciones en la composición y concentración de los glucosinolatos dentro del mismo género y/o especie atendiendo a la zona de recolección y las condiciones edafoclimáticas, sugiriendo su importancia en la adaptación a distintas condiciones ambientales. Además, se ha comprobado que no se distribuyen de forma homogénea en toda la planta, siendo las flores los órganos con mayor concentración de estos compuestos3, de ahí su interés como alimento (p ej. Las coles de Bruselas o la col) o condimento en distintas elaboraciones.
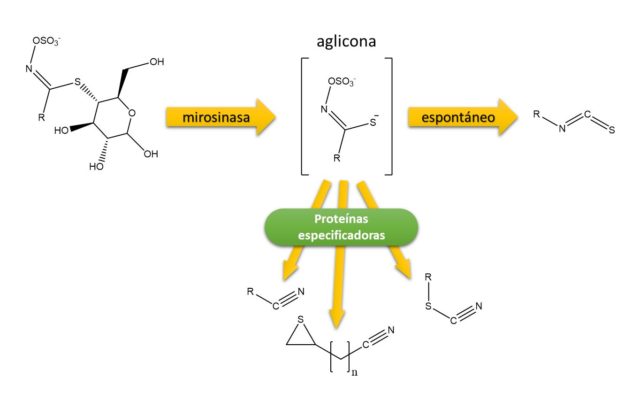
Para ejercer su papel en defensa, los glucosinolatos han de pasar por un proceso de hidrólisis catalizado por un enzima llamado mirosinasa que rompe el enlace tioglucósido provocando un reordenamiento molecular que genera distintos tipos de derivados: tiocianatos o isotiocianatos según el valor de pH, nitrilos en presencia de proteínas especificadoras o a pH 2-5 en presencia de iones Fe+3, oxazolidin-2-tionas cuando el glucosinolato precursor contiene un grupo hidroxilo o epitionitrilos si existe un doble enlace terminal que captura el azufre liberado durante la formación del nitrilo, que suele ser la forma más habitual en plántulas de Arabidopsis y colza4. En definitiva, la degradación de los glucosinolatos genera toda una serie de compuestos que resultan tóxicos para plagas fitófagas o para hongos fitopatógenos1. La combinación de glucosinolatos y mirosinasa se conoce como “mustard oil bomb” dado el carácter oleaginoso de las semillas de todas estas especies, por ello cuando machacamos semillas de colza o mostaza ponemos en contacto los glucosinolatos y la mirosinasa, liberándose todo su aroma y pungencia. Junto con la mirosinasa suelen encontrarse otras proteínas que regulan la conversión de glucosinolatos en los distintos productos de degradación: isotiocianatos, tiocianatos o nitrilos/epitionitrilos, siendo los primeros los que tienen una implicación directa en defensa (Figura 4).
Al igual que otros compuestos vegetales con un rol en nutrición y salud humanas, esta clase de compuestos también se han visto implicados en distintos procesos relacionados con la prevención de patologías. En concreto, el sulforafano, isotiocianato derivado de la glucorafanina (4-metillsulfinilbutil glucosinolato) (Figura 2) y abundante en las coles de Bruselas, la col o el kale, se ha estudiado muchísimo por su capacidad de inducir enzimas detoxificantes de fase II de mamíferos (p.ej. glutatión S-transferasa o quinona reductasa) implicados en la detoxificación de xenobióticos posibles carcinógenos y en la defensa frente a especies reactivas de oxígeno5–7, aunque no existe ningún ensayo clínico finalizado o en marcha ni ningún meta-estudio sobre su efectividad en la prevención del cáncer, varios estudios apuntan a su potencial preventivo. En este aspecto, recientemente se ha identificado un mecanismo por el cual los glucosinolatos intactos procedentes de la dieta podrían convertirse en sus productos de degradación, principalmente isotiocianatos, a través de la acción de la microbiota presente el tracto digestivo 8. Todos estos estudios ponen de manifiesto la enorme diversidad del metabolismo secundario vegetal y su potencial como fuente de precursores de nuevos fármacos para tratar diferentes patologías, así como su manipulación para la síntesis de nuevos compuestos a medida, empleando las plantas como biofactorías, como ya se ha propuesto para la producción de anticuerpos frente al SARS-CoV-2. Por ello, y a pesar de que las evidencias científicas indican un elevado potencial de estos compuestos en la protección frente al cáncer, hay que tener claro que consumir grandes cantidades de mostaza o wasabi no constituye una cura… aunque sea delicioso.
Este artículo nos lo envía Vicent Arbona. Doctor en Ciencias Biológicas y Profesor Titular en la Universitat Jaume I (Castelló de la Plana). Investiga en el papel de la regulación hormonal de las respuestas fisiológicas y metabólicas al ambiente en plantas, centrándose en la reconfiguración del metabolismo primario y secundario en condiciones en las que el oxígeno o los carbohidratos son limitantes. Si no fuera científico, sería artista, que es la segunda mejor manera de acercarse a la naturaleza. Twitter: @arbona_vicent
Inspirado por el hashtag #ThioGlucoThursday iniciado por Daniel J. Kliebenstein (@SpicyBotrytis)
Referencias científicas y más información:
- Schlaeppi, K., Abou-Mansour, E., Buchala, A. & Mauch, F. Disease resistance of Arabidopsis to Phytophthora brassicae is established by the sequential action of indole glucosinolates and camalexin. Plant J. 62, 840–851 (2010).
- Pedras, M. S. C. & Adio, A. M. Phytoalexins and phytoanticipins from the wild crucifers Thellungiella halophila and Arabidopsis thaliana: rapalexin A, wasalexins and camalexin. Phytochemistry 69, 889–93 (2008).
- Malik, M. S., Riley, M. B., Norsworthy, J. K. & Bridges, W. Variation of glucosinolates in wild radish (raphanus raphanistrum) accessions. J. Agric. Food Chem. 58, 11626–11632 (2010).
- Wentzell, A. M. & Kliebenstein, D. J. Genotype, age, tissue, and environment regulate the structural outcome of glucosinolate activation. Plant Physiol. 147, 415–429 (2008).
- Zhang, Y., Talalay, P., Cho, C.-G. & Posner, G. H. A major inducer of anticarcinogenic protective enzymes from broccoli: Isolation and elucidation of structure. Proc. Natl. Acad. Sci. U. S. A. 89, 2399–2403 (1992).
- Gorrini, C., Harris, I. S. & Mak, T. W. Modulation of oxidative stress as an anticancer strategy. Nat. Rev. Drug Discov. 12, 931–947 (2013).
- Dinkova-Kostova, A. T. et al. Direct evidence that sulfhydryl groups of Keap1 are the sensors regulating induction of phase 2 enzymes that protect against carcinogens and oxidants. Proc. Natl. Acad. Sci. U. S. A. 99, 11908–11913 (2002).
- Liou, C. S. et al. A Metabolic Pathway for Activation of Dietary Glucosinolates by a Human Gut Symbiont. Cell 180, 717-728.e19 (2020).
- Grubb, C. D. & Abel, S. Glucosinolate metabolism and its control. Trends Plant Sci. 11, 89–100 (2006).
- Jeschke, V., Gershenzon, J. & Vassao, D. G. Metabolism of Glucosinolates and Their Hydrolysis Products in Insect Herbivores. in The Formation, Structure and Activity of Phytochemicals (ed. Jetter, R.) 45, 163–194 (Springer International Publishing Switzerland, 2015).
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.
