Hace más de 15 años salieron al mercado las primeras transgénicas resistentes a insectos también conocidas como las famosas plantas Bt. Estas plantas tenían un gen procedente de una bacteria que normalmente vive en el suelo y que expresa una proteína que resulta tóxica para determinadas especies de insectos, especialmente, para las larvas de polillas (lepidópteros) y escarabajos (coleópteros).
Bt proviene de Bacillus thuringiensis, que es el nombre de la bacteria que acabamos de mencionar y responsable de la producción de una proteína que forma cristales llamada Cry. Esta bacteria fue aislada por primera vez en 1901 por un biólogo japonés llamado Shigetane Ishiwatari, quien la bautizó como Bacillus sotto. Diez años después, un científico alemán llamado Ernst Berliner, también aisló al mismo bacilo pero esta vez a partir de la larva de la polilla de la harina, en una provincia de Alemania llamada Turingia (“Thüringen”, en alemán). La describió y le dio el nombre que hoy lleva. Posteriormente se demostró el efecto insecticida de las proteínas Cry y se empezó a utilizar las esporas de esta bacteria como controlador biológico de plagas. Para 1938 ya se comercializaba en Francia bajo el nombre de Sporeine.

Si bien las esporas de Bt cumplían eficientemente con su función, su periodo de efectividad era muy corto, sobre todo cuando había lluvias y viento. Se debía aplicar varias veces durante una temporada de crecimiento para poder proteger el cultivo. Esto incrementaba los costos.
A mediados de la década de 1980, los científicos empezaron a introducir el gen que codificaba la proteína Cry en plantas de tomate y tabaco para que pudieran expresar las toxinas en sus propios tejidos. De esta manera, ya no habría la necesidad de rociar directamente las esporas de Bt en el campo de cultivo. Los primeros intentos fracasaron porque la biología de las bacterias (procariotas) y las plantas (eucariotas) eran completamente diferentes. Con algunas modificaciones a nivel del ADN del gen Cry (optimización de codones, uso de promotores y terminadores virales, etc.) se logró expresar la toxina Bt en cantidades suficientes como para proteger a la planta del ataque de las plagas. Finalmente, en 1995, la Agencia de Protección Ambiental de EEUU aprobó el registro de las primeras variedades transgénicas de papa, maíz y algodón Bt.
Lo demás es historia conocida. Las plantas Bt empezaron a cultivarse en diferentes países, salieron al mercado nuevas variedades con diferentes toxinas Bt y se redujo el uso de agroquímicos destinados al control de plagas. Sin embargo, este último efecto —la reducción del uso de pesticidas— tuvo un efecto inesperado…
El modo de acción de las toxinas Bt es complejo. Ingresa al insecto a través de la boca en forma inactiva (pro-toxina). Luego, unas enzimas específicas que cortan proteínas y el entorno alcalino de los intestinos modifican la pro-toxina activándola. Una vez activa, la toxina Bt se une a receptores específicos en la superficie intestinal y provoca que los poros de las membranas celulares se abran causando un movimiento descontrolado de moléculas y la afluencia de agua. La muerte llega en cuestión de horas.
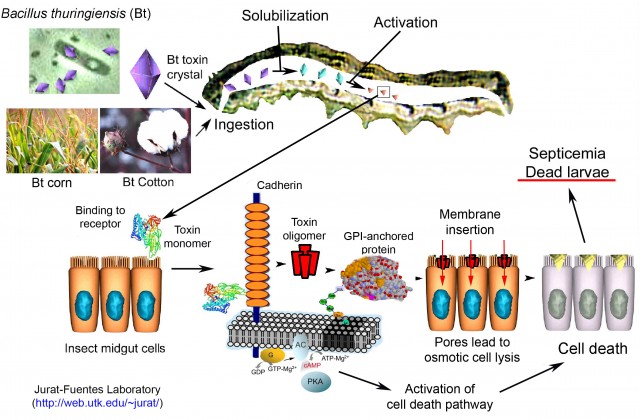
Como mencionamos anteriormente, las toxinas Bt son específicas para determinados grupos de insectos y, por su modo de acción, no afecta a los mamíferos. Asimismo, existen otros grupos de insectos como los Hemípteros que también son insensibles a las toxinas Bt. A este grupo pertenecen los áfidos o pulgones.
Los áfidos no se alimentan de hojas como lo hacen las larvas de las polillas o escarabajos. Más bien su boca es una especie de aguja hipodérmica que usa para succionar directamente los azúcares que circulan por el floema. El problema con los pulgones es que transmiten más de la mitad de los virus que infectan a las plantas y son responsables del 13% de las pérdidas agronómicas en el mundo.
Es así que la reducción en el uso de pesticidas y la insensibilidad innata que tienen los áfidos a las toxinas Bt han favorecido su proliferación en ciertos cultivos. Esto podría convertirse en un problema, ya sea porque aumentarían la transmisión de enfermedades virales en las plantas cultivadas o porque los pulgones emergerían como plagas secundarias.
En el sudeste australiano, vive una pequeña araña sumamente venenosa, se la conoce como araña de tela de embudo y produce una neurotoxina que es letal para casi todos los insectos —pero no para los mamíferos— llamada ω-atracotoxin-HV1 (HV1a, para los amigos). Esta neurotoxina es un péptido de 37 aminoácidos que provoca un flujo anormal de iones en las neuronas, seguido por una parálisis flácida que finalmente termina con la muerte del insecto. A pesar de su potencial uso como biopesticida, a la fecha no ha sido aprovechada en el control de plagas.
A más de 14.000 Km de distancia, se encuentra el Departamento de Patología Vegetal de la Iowa State University (EEUU) donde el Dr. Allen Miller tiene su laboratorio. En él trabaja un grupo de científicos que buscan la forma de hacer frente al problema de los áfidos, expresando la neurotoxina HV1a en diferentes plantas cultivadas. El problema es que la letalidad de esta neurotoxina depende de si ingresa o no al hemocele —la cavidad corporal por donde circula la hemolinfa (la “sangre” de los insectos). En otras palabras, este veneno no debe ser administrado por vía oral (como el Bt) sino por vía “intravenosa”. Y ya se imaginarán lo ridículo que sería vender veneno para áfidos inyectable.
Entonces, lo que necesitaban era un repartidor. Una molécula que transporte la neurotoxina HV1a desde el tracto digestivo hacia el hemocele del áfido. Y hallaron la luz al final del túnel en un diminuto virus llamado luteovirus.
Los luteovirus infectan específicamente a los áfidos. Ingresan al insecto a través del floema y mediante un mecanismo llamado transcitosis (el virus es transportado dentro de una vesícula a través de la célula) penetran la pared de los intestinos hasta alcanzar el hemocele. Finalmente, los virus migran hacia las glándulas salivales del áfido, se multiplican y son liberados a una nueva planta hospedera, para empezar el ciclo nuevamente.
Desde hace algunos años se sabe que la transmisión de los luteovirus se da gracias a dos proteínas estructurales: la proteína de la cubierta viral (PCV) y la RTD; sin embargo, sólo se requiere la primera para que el virus ingrese al hemocele. Entonces, los científicos de la Iowa State University tuvieron la genial idea de fusionar los genes que codifican la PCV con la neurotoxina HV1a, para que así la neurotoxina llegue al hemocele.
Antes de lanzarse al abismo probaron la idea fusionando el gen de la PCV con el gen de la proteína fluorescente verde (GFP). Insertaron esta construcción genética en el genoma de una planta llamada Arabidopsis thaliana y pusieron algunos áfidos sobre ella. Los resultados fueron muy buenos: la hemolinfa brillaba de color verde. Esto indicaba que la GFP había logrado ingresar al hemocele gracias a la PCV del luteovirus.
Entonces, los investigadores hicieron lo mismo, pero esta vez cambiaron el gen de la GFP por el gen de la neurotoxina HV1a. La A. thaliana expresó sin problemas la construcción genética insertada: el 0,45% del contenido proteico del floema era la neurotoxina fusionada a la proteína de la cubierta viral. Luego, cuando se la puso en contacto con cuatro especies de áfidos diferentes, todos estiraron la pata [literalmente] al cabo de unos días. Por otro lado, cuando se puso larvas de Lepidópteros sobre las A. thaliana transformadas, no hubo efecto negativo alguno sobre ellas, demostrando así la especificidad de la neurotoxina.

Este breve relato nos muestra los potenciales de la ingeniería genética para afrontar los problemas que aquejan hoy a la agricultura tomando de la misma naturaleza los elementos necesarios para conseguirlo.
Referencias:
- Bonning BC, Pal N, Liu S, et al. Toxin delivery by the coat protein of an aphid-vectored plant virus provides plant resistance to aphids. Nat Biotechnol. 2013. doi: 10.1038/nbt.2753
- Sanahuja G, Banakar R, Twyman RM, Capell T, Christou P. Bacillus thuringiensis: a century of research, development and commercial applications. Plant Biotechnol J. 2011. 9(3): 283-300. doi: 10.1111/j.1467-7652.2011.00595.x
Biólogo de la Universidad Nacional Agraria La Molina (Lima, Perú) con estudios de maestría en biología molecular. Trabajó primero con plantas, luego con radiofármacos y finalmente con bacterias intracelulares. Actualmente trabaja en el área de biotecnología y bioseguridad del sector gubernamental de su país. Escribe sobre ciencia en sus ratos libres tratando que la gente se interese en ella tanto como él.
