Cualquier célula de nuestro organismo obtiene la energía para poder seguir realizando sus funciones vitales mediante la oxidación de compuestos orgánicos, en un proceso que recibe el nombre de respiración y que necesita la presencia de oxígeno para llevarse a cabo -respiración aerobia-. Los glúcidos -azúcares- son los materiales utilizados normalmente por la célula para cubrir sus requerimientos energéticos, concretamente la glucosa, a menudo procedente de la hidrólisis de azúcares más complejos. La respiración aerobia de la glucosa se divide en tres etapas: glucolisis, ciclo de Krebs y cadena transportadora de electrones, al final de las cuales la célula obtendrá energía química en forma de ATP -adenosín trifosfato-. La primera de ellas se lleva a cabo en el citoplasma celular, las otras dos en la mitocondria.
Fue el bioquímico alemán Otto Warburg quien ya en 1924 comprobó que las células tumorales siguen un camino diferente al de las células sanas en cuanto a la obtención de energía. El desvío del metabolismo normal al metabolismo tumoral se produce al final de la primera de estas tres etapas: el piruvato resultante de la glucolisis normalmente va a entrar en la mitocondria en forma de acetil-coA para seguir el ciclo de Krebs. Sin embargo, en la célula tumoral, este piruvato no seguirá el camino habitual, sino que será desviado hacia la producción de ácido láctico, incluso en presencia de oxígeno suficiente para hacer una oxidación completa de la glucosa siguiendo las tres etapas mencionadas más arriba.
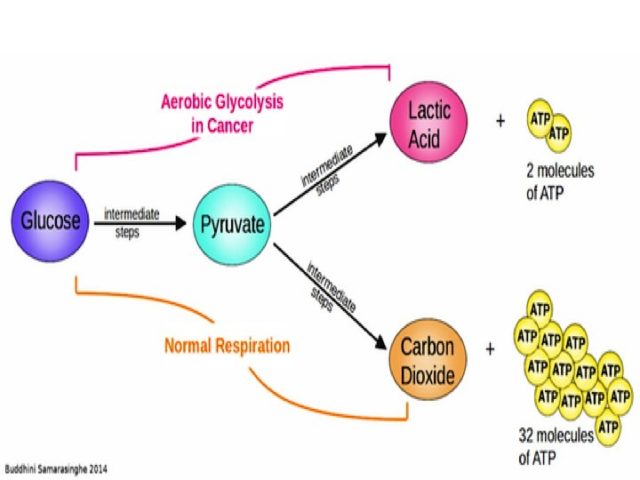
Este desvío metabólico implicará un rendimiento energético mucho menor para la célula -se obtendrá mucho menos ATP produciendo ácido láctico que siguiendo la vía convencional que incluye las tres etapas de oxidación de la glucosa-. Como consecuencia, la célula tumoral se verá obligada a captar enormes cantidades de glucosa. Este incremento de la vía glucolítica se conoce como “efecto Warburg” y fue propuesto por su descubridor como la causa del cáncer. Warburg se basaba en una función mitocondrial alterada en las células tumorales. Había observado que las mitocondrias de dichas células suelen ser más pequeñas y con defectos morfológicos. De esta manera justificaba que el producto de la glucolisis -el piruvato- no pudiese entrar en ellas y la respiración de la glucosa no pudiese seguir el camino habitual, desviándose hacia la producción del ácido láctico.
Hoy en día, sin embargo, no está tan claro que el desvío del metabolismo sea la causa de esta enfermedad, ya que se sabe que muchas de las células presentes en un tumor muestran un metabolismo oxidativo de la glucosa completamente normal, es decir, en sus mitocondrias puede llevarse a cabo el ciclo de Krebs y la cadena transportadora de electrones. Dentro de un tumor se ha comprobado que existen tanto células con predominio de un metabolismo desviado hacia el ácido láctico, como células con predominio de un metabolismo oxidativo clásico. La proporción entre unas y otras varía dependiendo del tipo de tumor del que se trate o del estadío del mismo. Muchos autores actuales piensan que el efecto Warburg es más bien una consecuencia del cáncer y no su causa como afirmó el bioquímico alemán, aunque no hay una conclusión definitiva en este campo.

El metabolismo tumoral también está relacionado con las fluctuaciones de oxígeno. La alta tasa de replicación de las células cancerosas supera a la formación de vasos sanguíneos, resultando en una vasculatura defectuosa que conduce a una deficiente oxigenación local. La falta de oxígeno provoca la activación del HIF-1 -factor inducible por hipoxia-, una proteína que actúa en el núcleo celular activando la respuesta a la escasez de oxígeno y que controla la expresión de más de cien genes, entre los que están genes que controlan el desarrollo de vasos sanguíneos, transportadores de glucosa y enzimas glucolíticos o factores de supervivencia e invasividad tumoral. Esta sobreexpresión de los transportadores de glucosa y de enzimas de la vía glucolítica determinan dos de las características principales de muchas de las células que se encuentran en el tumor: su elevada tasa de captación de glucosa y el consecuente aumento en la glucolisis que se observa en ellas.
Entre las acciones promovidas por el HIF-1 hay dos de especial relevancia:
- Induce la actividad de la PDK-1 -piruvato deshidrogenasa quinasa-. Esta proteína evita que el piruvato obtenido en la glucolisis entre en el ciclo de Krebs.
- Activa la lactato deshidrogenasa, proteína que transformará el piruvato en ácido láctico.
Se sabe que la sinergia con determinados oncogenes potencia y favorece estas dos acciones clave en el metabolismo tumoral.

Mientras el balance energético global de la respiración aerobia de la glucosa es de 38 ATP, el procesamiento del ácido láctico utilizado por las células tumorales como vía energética principal produce tan solo 2 ATP. Por tanto, ¿por qué en las células tumorales se ve favorecida la vía del ácido láctico? Se han propuesto varias hipótesis, como la mayor facilidad para la supervivencia de estas células en el ambiente fluctuante en oxígeno de los tumores, la obtención por esta vía de defensas frente a agentes quimioterápicos, la mayor facilidad para sintetizar ácidos grasos y otros compuestos relacionados con el crecimiento y la proliferación celular, un camino más rápido para la obtención de energía e incluso una mayor capacidad de evasión de la apoptosis -muerte celular programada-.
Gatenby y Gillies proponen que la selección favorecería la supervivencia de células con fenotipo resistente a la acidez, ya que crean un microambiente nocivo para las células sanas, pero inocuo para ellas mismas.
Las condiciones de hipoxia y de acidosis reinantes en un tumor, no sólo contribuyen a la progresión del tumor primario, sino que también pueden favorecer la formación de metástasis. Un número importante de proteínas implicadas en metástasis son inducidas por el HIF-1.
Por último, el elevado ritmo de captación de glucosa por los tumores ha servido para desarrollar una importante prueba de diagnóstico por imagen, como es la tomografía por emisión de positrones -PET-, consistente en la inyección al paciente de 18-fluorodesoxiglucosa -FDG- (análogo de la glucosa parcialmente metabolizable) y la detección de su captación.
Este artículo nos lo envía Sergio Álvarez (@Sergio203bio), Licenciado en Biología y Máster en Sistemas de Gestión por la Universidad de Oviedo. Profesor de Biología y Geología en Enseñanza Secundaria. En su web «el blog de las especies singulares» escribe sobre especies raras y en peligro de extinción.
Referencias científicas y más información:
- Adewale, F., Ajiboye, B., Ojo, O. et al. Biology of glucose metabolization in cancer cells. Journal of Oncological Sciences: 3 (2): 45-51, 2017.
- Boticario, C. y Cascales, M. Hipoxia y cáncer. R. Acad. Nac. Farm. 76 (3): 379-408, 2010.
- Devic, S. Warburg effect – A consequence or the cause of carcinogenesis? J Cancer. 7 (7): 817–822, 2016.
- Jones, R. y Thompson, C. Tumor suppressors and cell metabolism: a recipe for cancer growth. Genes and development: 23: 537-548, 2009.
- Martínez Costa, O. Glicolisis, efecto Warburg y flexibilidad metabólica tumoral. Sociedad Española de Bioquímica y Biología Molecular. 2015. org/10.18567/sebbmdiv_RPC.2015.06.1
- Muñoz, C. El metabolismo del cáncer. Sociedad Española de Bioquímica y Biología Molecular. doi.org/10.18567/sebbmdiv_ANC.2013.08.1
- Pavlova, N. y Thompson, C. The emerging hallmarks of cancer metabolism. Cell Metabolism Perspective: 23: 27-47, 2016. doi: 10.1016/j.cmet.2015.12.006
- Solaini, G., Sgarbi, G. y Baracca, A. Oxydative phosphorylation in cancer cells. Biochimica et Biophysica Acta (BBA) – Bioenergetics: 1807 (6): 534-542, 2011. doi.org/10.1016/j.bbabio.2010.09.00
Libros
Gómez Capilla, J.A., Gómez Llorente, C.: Iniciación al estudio de la bioquímica. Base universitaria. Anaya (2009).
Si tienes un artículo interesante y quieres que lo publiquemos en Naukas como colaborador invitado, puedes ponerte en contacto con nosotros.

